
科目: 來源:不詳 題型:計算題
質量分數(shù) | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 98% |
密度(g/mL) | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
查看答案和解析>>
科目: 來源:不詳 題型:計算題
查看答案和解析>>
科目: 來源:不詳 題型:計算題

查看答案和解析>>
科目: 來源:不詳 題型:計算題
 下表(假設紙張其他成分既不溶于水,也不與水反應):
下表(假設紙張其他成分既不溶于水,也不與水反應):| | 燒杯① | 燒杯② | 燒杯③ | 燒杯④ | 燒杯⑤ |
| 加入樣品的質量/g | 10 | 10 | 10 | 10 | 10 |
 加入稀鹽酸的質量/g 加入稀鹽酸的質量/g | 10 | 20 | 30 | 40 | 50 |
| 充分反應后生成氣體的質量/g | 0.88 | 1.76 | X | 3.52 |  3.52 3.52 |
查看答案和解析>>
科目: 來源:不詳 題型:計算題
實驗次數(shù) | 1 | 2 | 3 | 4 | 5 |
稀鹽酸的累計加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0 g |
剩余固體的質量 | 1.5g | 1.0g | 0.5g | 0.3g | 0.3g |
查看答案和解析>>
科目: 來源:不詳 題型:計算題
查看答案和解析>>
科目: 來源:不詳 題型:計算題
查看答案和解析>>
科目: 來源:不詳 題型:計算題

查看答案和解析>>
科目: 來源:不詳 題型:計算題
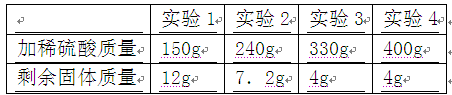
查看答案和解析>>
科目: 來源:不詳 題型:計算題
實驗l | 實驗2 | 實驗3 | 實驗4 | |
鋼樣粉末質量 | 2.84g | 4.26g | 6.23g | 7.5lg |
生成H2的質量 | 0.10g | 0.15g | 0.20g | 0.20g |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com