【題目】SO2和氮氧化物的轉(zhuǎn)化和綜合利用既有利于節(jié)約資源��,又有利于保護環(huán)境�。
⑴H2還原法是處理燃煤煙氣中SO2的方法之一�����。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)= H2O(g) ΔH=c kJ·mol—1
寫出SO2(g)和H2(g)反應生成S(s)和H2O(g)的熱化學方程式:_____________����。
⑵20世紀80年代Townley首次提出利用電化學膜脫除煙氣中SO2的技術(shù):將煙氣預氧化使SO2轉(zhuǎn)化為SO3,再將預氧化后的煙氣利用如圖所示原理凈化利用����。
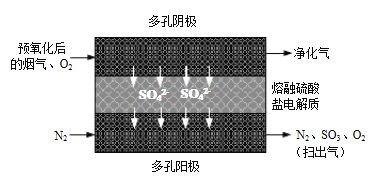
①陰極反應方程式為_____________����。
②若電解過程中轉(zhuǎn)移1mol電子�,所得“掃出氣”用水吸收最多可制得質(zhì)量分數(shù)70%的硫酸_____________g。
⑶利用脫氮菌可凈化低濃度NO廢氣��。當廢氣在塔內(nèi)停留時間均為90s的情況下�����,測得不同條件下NO的脫氮率如圖Ⅰ����、Ⅱ所示��。
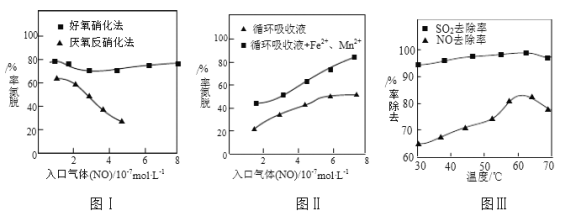
①由圖I知�,當廢氣中的NO含量增加時,宜選用____________法提高脫氮效率�����。
②圖Ⅱ中�����,循環(huán)吸收液加入Fe2+、Mn2+提高了脫氮的效率�����,其可能原因為_____________����。
⑷研究表明:NaClO2/H2O2酸性復合吸收劑可同時有效脫硫、脫硝��。圖Ⅲ所示為復合吸收劑組成一定時��,溫度對脫硫脫硝的影響�。
①溫度高于60℃后,NO去除率隨溫度升高而下降的原因為_____________��。
②寫出廢氣中的SO2與NaClO2反應的離子方程式:____________���。