【題目】根據(jù)已經(jīng)學(xué)過的化學(xué)知識,回答下列問題���。
I.(1)現(xiàn)有下列十種物質(zhì):①蔗糖 ②熔融KNO3 ③石墨 ④銅絲 ⑤NaOH固體 ⑥SO3 ⑦BaSO4固體 ⑧K2O固體 ⑨液態(tài)H2SO4 ⑩液氯 上述物質(zhì)中可導(dǎo)電的是____________(填序號,下同)�����;上述物質(zhì)中不能導(dǎo)電�����,但屬于電解質(zhì)的是_______________________。
(2)NaHSO4是一種酸式鹽����,請?zhí)顚懴铝锌瞻祝?/span>
①寫出NaHSO4在水中的電離方程式____________________________________。
②與0.1 mol·L—1的NaHSO4溶液的導(dǎo)電能力相同的硫酸鈉溶液的物質(zhì)的量濃度為:_____����。
③NaHSO4溶液與NaHCO3溶液反應(yīng)的離子方程式為______________________________。
(3)粗鹽中含可溶性CaCl2�、MgCl2及一些硫酸鹽,除去這些雜質(zhì)的試劑可選用��,①Na2CO3����、②NaOH、③BaCl2��、④HCl��,用序號表示加入的先后順序依次是_________���。
II.A�����、B��、C����、X均為中學(xué)常見物質(zhì),它們在一定條件下有如下轉(zhuǎn)化關(guān)系(副產(chǎn)物已略去)�。
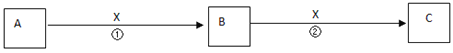
(1)若X是氧氣,則A不可能 ______(填序號)
A.C B.SiC.NaD.Mg
(2)若X是金屬單質(zhì)���,向淺綠色溶液C中滴入AgNO3溶液����,產(chǎn)生了不溶于稀HNO3的白色沉淀�,則B的化學(xué)式為__________;C溶液在貯存時應(yīng)加入少量X��,理由是(用離子方程式表示)________________�。