【題目】丙烷脫氫是工業(yè)生產(chǎn)丙烯的重要途徑��,其熱化學(xué)方程式為:C3H8(g) 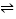 C3H6(g)+H2(g) ΔH�。請(qǐng)回答下列相關(guān)問題。
C3H6(g)+H2(g) ΔH�。請(qǐng)回答下列相關(guān)問題。
(1)下表為部分鍵能數(shù)據(jù)����,據(jù)此可算出△H=_________kJ/mol。
化學(xué)鍵 | C—C | C=C | C—H | H—H |
鍵能(kJ/mol) | 332 | 611 | 414 | 436 |
(2)一定溫度下����,向2L的密閉容器中充入2molC3H8發(fā)生脫氫反應(yīng),經(jīng)過10min達(dá)到平衡狀態(tài)��,測得平衡時(shí)氣體壓強(qiáng)是開始的1.4倍��。
①0~10 min內(nèi)氫氣的生成速率v(H2)=__________����,C3H8的平衡轉(zhuǎn)化率為_________。
②下列情況能說明該反應(yīng)達(dá)到平衡狀態(tài)的是___________�。
A.混合氣體的平均分子量保持不變
B. C3H6與H2的物質(zhì)的量之比保持不變
C.混合氣體的密度保持不變
D. C3H8的分解速率與C3H6的消耗速率相等
(3)脫氫反應(yīng)分別在壓強(qiáng)為p1和p2時(shí)發(fā)生����,丙烷及丙烯的平衡物質(zhì)的量分?jǐn)?shù)隨溫度變化如圖所示��。

①壓強(qiáng):p1______p2(填“>”或“<”)��。
②為了同時(shí)提高反應(yīng)速率和反應(yīng)物的平衡轉(zhuǎn)化率���,可采取的措施是__________。
③若p1=0.1 MPa����,起始時(shí)充入丙烷發(fā)生反應(yīng),則Q點(diǎn)對(duì)應(yīng)溫度下����,反應(yīng)的平衡常數(shù)Kp_____(用平衡分壓代替平衡濃度計(jì)算,分壓=總壓×物質(zhì)的量分?jǐn)?shù))�����。
④在恒溫����、恒壓的密閉容器中充入丙烷和氬氣發(fā)生脫氫反應(yīng)��,起始n(氬氣)/n(丙烷)越大����,丙烷的平衡轉(zhuǎn)化率越大,其原因是___________________�。