“中和熱的測定”實驗步驟為:
① 準備反應(yīng)裝置(如右圖)�����。
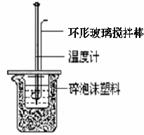
② 用一個量筒量取40 mL 0.50 mol/L鹽酸��,倒入小燒杯中��,并用溫度計測量鹽酸的溫度��,記錄�。然后把溫度計上的酸用水沖洗干凈����。
③ 用另一個量筒量取40 mL 0.55 mol/LNaOH溶液,并用溫度計測量NaOH溶液的溫度���,記錄�。
④ 把溫度計和_____________________放入小燒杯的鹽酸中,并把量筒中的NaOH溶液一次倒入小燒杯(注意不要灑到外面)����。用環(huán)形玻璃攪拌棒輕輕攪動溶液,并準確讀取混合溶液的最高溫度����。
⑤_____________________________________________________________________。
⑥ 根據(jù)實驗數(shù)據(jù)計算中和熱����。
請回答下列問題
(1)補全第④步中所缺儀器__________________。
(2)補全第⑤步操作步驟__________________�����。
(3)第②步如果不把溫度計上的酸用水沖洗干凈直接測量NaOH溶液的溫度���,則測得的ΔH__________________����。(填“偏大”“偏小”或“無影響”)�����。
(4)近似認為0.50 mol/L鹽酸0.55 mol/LNaOH溶液的密度都是1g/mL,中和后生成的溶液的比熱容c=4.18J/(g·℃)����,起始平均溫度為t1℃�,反應(yīng)后最高溫度為t2℃,則中和熱(不用化簡):
ΔH=__________________���。
(5)0.50L 1.00 mol/L H2SO4溶液與1.00 L 1.00 mol/L NaOH溶液完全反應(yīng),放出57.16kJ的熱量�,寫出該中和反應(yīng)的熱化學(xué)方程式
__________________________________________________________________��。
(6)_______(填“能”或“不能”)用稀Ba(OH)2和稀硫酸代替鹽酸和NaOH溶液���,理由是____________________________________________________________����。