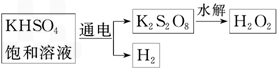
某同學利用下圖所示方法制取一定濃度的雙氧水,并且測定其質量分數(shù)
請回答下列問題:
(1)電解KHSO4飽和溶液時���,陽極的電極反應式為___________________.
(2)測定所得H2O2溶液的質量分數(shù):
①移取10.00 mL H2O2溶液(密度為1.00 g/mL)至250 mL ________(填儀器名稱)中�����,加水稀釋至刻度����,搖勻.移取稀釋后的H2O2溶液25.00 mL至錐形瓶中,加入稀硫酸酸化���,用蒸餾水稀釋����,作被測試樣.
②用0.0100 mol/L高錳酸鉀標準溶液滴定被測試樣���,其反應的離子方程式如下�,請將相關物質的化學計量數(shù)填寫在方框里.
③滴定時��,高錳酸鉀溶液應裝在________.滴定到達終點的現(xiàn)象是__________________________________.
④上述操作②中�,滴入第一滴KMnO4溶液,溶液紫紅色消失很慢��,隨著滴定過程中Mn2+的增多��,溶液紫紅色消失速率迅速加快.則Mn2+作用的是________________________.
⑤若滴定前俯視讀數(shù)���,滴定后仰視讀數(shù)�����,則測定結果________(填“偏高”����、“偏低”或“不變”).
⑥用同樣方法滴定�����,三次消耗KMnO4溶液的體積分別為20.00 mL��、19.98 mL����、20.02 mL.則所得H2O2溶液的質量分數(shù)是__________________.