
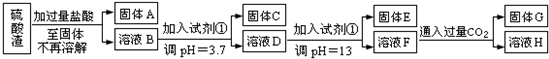
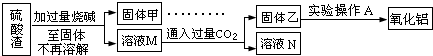
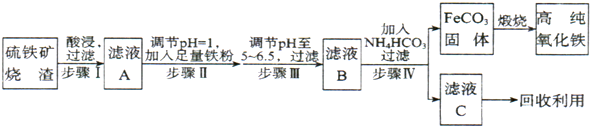
�}Ŀ�б�(�����𰸺ͽ���)
| 1 |
| 2 |
 O2��g����H2=a���f�������_���ǣ� ��
O2��g����H2=a���f�������_���ǣ� ��| 1 |
| 2 |
| A������ʽ�л��WӋ����Ա�ʾ���Ӕ�(sh��) |
| B��a(ch��n)��0 |
| C��a(ch��n)=-285.9kJ?mol-1 |
| D����H2��ʾ18gˮ�ֽ�r�ų��ğ��� |
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com