
題目列表(包括答案和解析)
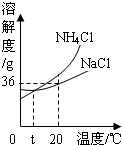 我國著名化學家侯德榜發(fā)明的“聯(lián)合制堿法”的反應原理用化學方程式可簡要表示為:
我國著名化學家侯德榜發(fā)明的“聯(lián)合制堿法”的反應原理用化學方程式可簡要表示為:
| ||
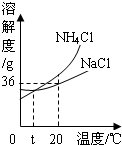 我國著名化學家侯德榜發(fā)明的“聯(lián)合制堿法”的反應原理用化學方程式可簡要表示為:
我國著名化學家侯德榜發(fā)明的“聯(lián)合制堿法”的反應原理用化學方程式可簡要表示為: Na2CO3+H2O+CO2
Na2CO3+H2O+CO2湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com