【題目】小明同學上網(wǎng)查閱了如下資料:
中心原子雜化類型的判斷方法:
(1)公式:n=(中心原子的價電子數(shù)+配位原子的成鍵電子數(shù)電荷數(shù))/2
說明:配位原子為氧原子或硫原子時�,成鍵電子數(shù)看為0;當電荷數(shù)為正值時����,公式中取“-”號,當電荷數(shù)為負值時��,公式中取“+”號����。
(2)根據(jù)n值判斷雜化類型:
當n=2時為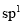 雜化���;n=3時為
雜化���;n=3時為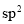 雜化��;n=4時為
雜化��;n=4時為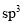 雜化����。
雜化����。
請運用該方法計算下列微粒的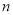 值�����,并判斷中心原子的雜化類型。
值�����,并判斷中心原子的雜化類型。
(1)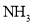 :n= __________��,__________雜化�;
:n= __________��,__________雜化�;
(2)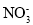 :n= __________,__________雜化�����;
:n= __________,__________雜化�����;
(3)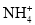 :n= __________���,__________雜化��;
:n= __________���,__________雜化��;
(4)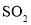 :n= __________�����,__________雜化�����。
:n= __________�����,__________雜化�����。