【題目】利用化學(xué)原理對(duì)廢氣��、廢水進(jìn)行脫硝����、脫碳處理���,可實(shí)現(xiàn)綠色環(huán)保����、廢物利用����,對(duì)構(gòu)建生態(tài)文明有重要意義。
Ⅰ.脫硝:
(1)H2還原法消除氮氧化物
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+133 kJ/mol
H2O(g)=H2O(l) ΔH2=-44 kJ/mol
H2的燃燒熱ΔH3=-285.8 kJ/mol
在催化劑存在下����,H2還原NO2生成水蒸氣和氮?dú)獾臒峄瘜W(xué)方程式為__________。
(2)用NH3催化還原法消除氮氧化物���,發(fā)生反應(yīng):
4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH<0
5N2(g)+6H2O(l) ΔH<0
相同條件下�,在2L恒容密閉容器中,選用不同催化劑���,產(chǎn)生N2的量隨時(shí)間變化如圖所示。
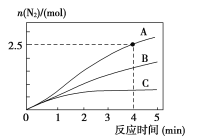
①計(jì)算0~4分鐘在A催化劑作用下�����,反應(yīng)速率v(NO)=____�����。
②下列說法正確的是____��。
A.該反應(yīng)的活化能大小順序是:Ea(A)>Ea(B)>Ea(C)
B.增大壓強(qiáng)能使反應(yīng)速率加快�����,是因?yàn)樵黾恿嘶罨肿影俜謹(jǐn)?shù)
C.單位時(shí)間內(nèi)H-O鍵與N-H鍵斷裂的數(shù)目相等時(shí)��,說明反應(yīng)已達(dá)到平衡
D.若反應(yīng)在恒容絕熱的密閉容器中進(jìn)行�,當(dāng)K值不變時(shí),說明已達(dá)到平衡
(3)利用原電池反應(yīng)可實(shí)現(xiàn)NO2的無害化����,總反應(yīng)為6NO2+8NH3=7N2+12H2O�����,電解質(zhì)溶液為NaOH溶液����,工作一段時(shí)間后��,該電池正極區(qū)附近溶液pH_____(填“增大”“減小”或“不變”)����,負(fù)極的電極反應(yīng)式為________。
Ⅱ.脫碳:
(4)用甲醇與CO反應(yīng)生成醋酸可消除CO污染�。常溫下,將a mol/L醋酸與b mol/L Ba(OH)2溶液等體積混合�,充分反應(yīng)后,溶液中存在2c(Ba2+)=c(CH3COO-)����,忽略溶液體積變化,計(jì)算醋酸的電離常數(shù)Ka=________(用含a��、b的代數(shù)式表示)�����。