
科目: 來源: 題型:
| 溫度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
| 溫度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
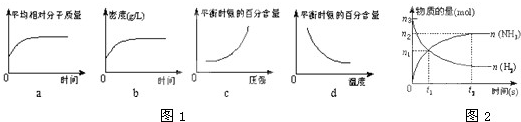
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
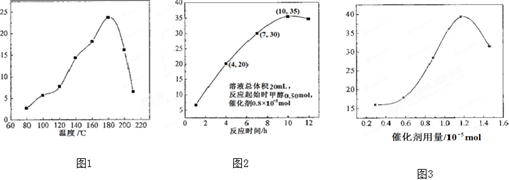
查看答案和解析>>
科目: 來源: 題型:
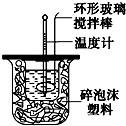 如圖裝置測定中和熱的實驗步驟如下:
如圖裝置測定中和熱的實驗步驟如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com