
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
 ���������1000mL 0.1mol•L-1��(bi��o)��(zh��n)Na2CO3��Һ��Ո�ش����І��}��
���������1000mL 0.1mol•L-1��(bi��o)��(zh��n)Na2CO3��Һ��Ո�ش����І��}���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
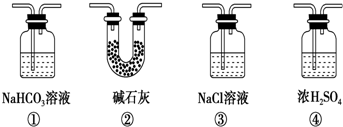
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

| �ض� ���Δ�(sh��) | ��ʼ�ض�t1/�� | �Kֹ�ض�t��/�� | �ضȲ�ƽ��ֵ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | CH3CH2Br�ķ��c��CH3CH3�ķ��c�� | |
| B�� | �����u���N���܉�l(f��)��ˮ�ⷴ��(y��ng)����ȥ����(y��ng) | |
| C�� | �������cNa0Hˮ��Һ����������ϩ | |
| D�� | ���������м���AgN03��Һ�������a(ch��n)�����Sɫ���� |
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com