
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | ���I�ǻ��W(xu��)�I | |
| B�� | ������cˮ�γɚ��I | |
| C�� | �Ҵ����Ӹ�ˮ����֮�g���ڷ����A���͚��I | |
| D�� | �⻯��ķ��c(di��n)���Ȼ���ķ��c(di��n)�������ڵ⻯�����֮�g���ښ��I |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
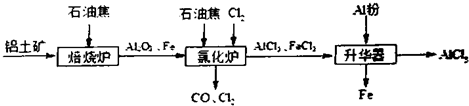
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ���(sh��)�(y��n)�}
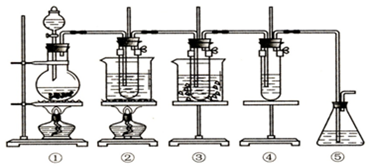
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
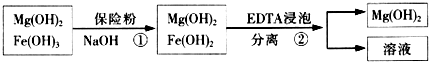
| ������ȼ���ėl�� | ��ȼ���F���� | |||
| ��̖(h��o) | �ἃ�wϵ�ض�/�� | ����EDTA�|(zh��)��/g | ���뱣�U(xi��n)���|(zh��)��/g | W��Fe��/��10-4g�� |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| ��(sh��)�(y��n)��̖(h��o) | c��HA��/mol•L-1 | c��NaOH��/mol•L-1 | �����Һ��pH |
| �� | 0.1 | 0.1 | pH=a |
| �� | 0.2 | 0.2 | pH=9 |
| �� | c1 | 0.2 | pH=7 |
| �� | 0.2 | 0.1 | pH��7 |
| A�� | c1=0.2 | |
| B�� | ���M���Һ��c��Na+����c��A-����c��H+����c��OH-�� | |
| C�� | a��9 | |
| D�� | ���ҽM���Һ����ˮ��x����c��OH-��=10-5mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | ÿ��(g��)ˮ���Ӄ�(n��i)���Ѓɂ�(g��)���I | |
| B�� | ֻҪ�К�Ԫ�ؾ����γɚ��I | |
| C�� | �����g���γɚ��Iʹ���|(zh��)�����c(di��n)�ͷ��c(di��n)���� | |
| D�� | HF�ķ�(w��n)���Ժ�(qi��ng)������?y��n)�������g���γɚ��I |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | �ٺ͢� | B�� | �� | C�� | �ۺ͢� | D�� | ���϶�����(du��) |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | 3.36 L | B�� | 4.48 L | C�� | 5.6 L | D�� | 6.72 L |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | NaOH | B�� | H2SO4 | C�� | Na2CO3 | D�� | Na2SO4 |
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)��(zhu��n)�^(q��) | ����p�_�e��(b��o)��(zhu��n)�^(q��) | ��vʷ̓�o(w��)���x�к���Ϣ�e��(b��o)��(zhu��n)�^(q��) | �����֙�(qu��n)�e��(b��o)��(zhu��n)�^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ(hu��)��027-86699610 �e��(b��o)�]�䣺58377363@163.com