【題目】高聚物G可用于生產降解塑料�����,合成G的有關轉化關系如下
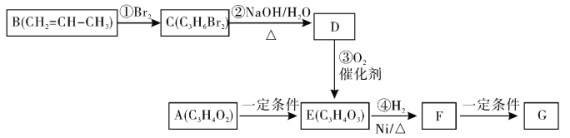
已知:物質A能夠發(fā)生銀鏡反應�,請回答下列問題:
(1)寫出物質D的結構簡式___________���,C的名稱為___________。
(2)F的官能團名稱為___________����。A→E的反應類型為:___________���。
(3)下列說法正確的是___________(填字母序號)�。
A.1molE與足量的H2在一定條件下發(fā)生反應���,最多消耗2molH2
B. 1mol F與足量NaOH溶液反應,最多消耗1 molNaOH
C.物質B存在順反異構體
D.D能使酸性高錳酸鉀溶液褪色
(4)寫出物質A發(fā)生銀鏡反應的化學方程式:_________________________________�����。
(5)寫出F→G的化學方程式:_________________________________�。
(6)化合物F有多種同分異構體,寫出符合下列條件F的二種同分異構體的結構簡式:____��、_____����。
①能與NaOH溶液反應��;②能發(fā)生銀鏡反應